
Inmunólogo Director, “Centro de Inmuno-Diagnóstico Especializado (CIDE)”
Un antígeno se define como cualquier molécula que induce una respuesta inmune, en el caso que el antígeno sea un virus, la respuesta inmune que desencadena nos protege de infectarnos y enfermarnos, ya sea la respuesta de tipo humoral, mediada por células B que producen anticuerpos, o celular, mediada por células T que por contacto eliminan a células infectadas. Las moléculas más inmunogénicas son aquellas que inducen una respuesta inmune robusta y protectora, por excelencia, las proteínas son los mejores antígenos pues las células T, responsables de la memoria inmunológica, solo reconocen proteínas. Esta es la razón por la cual tenemos muy buenas vacunas contra enfermedades virales y vacunas muy pobres contra enfermedades bacterianas, ya que las bacterias están principalmente compuestas por carbohidratos y lípidos, que son moléculas poco inmunogénicas.
El virus SARS-CoV-2, responsable de causar la enfermedad COVID-19, está compuesto de proteínas en un 95% y, por tanto, se clasifica como un potente antígeno que debería inducir una respuesta inmune robusta en personas que se infectan y que se recuperan. Como lo demuestra la evidencia que más de 221 millones de personas se han infectado a nivel mundial, pero ha sido un reducido porcentaje las que se han reinfectado y han terminado hospitalizados, o fallecidos. Similar a las vacunas contra COVID, la infección natural protege muy bien de enfermarse con gravedad, pero no tanto de reinfectarse y tener síntomas leves.
La primera línea de defensa del sistema inmune al verse infectado por el antígeno SARS-CoV-2 es reconocer todas las proteínas que lo conforman y luego producir anticuerpos que reaccionan contra todos los “parches” de dichas proteínas, definiendo un “parche” como la forma espacial de una parte de la proteína En el caso de las vacunas que circulan en el país (Pfizer, Moderna, Sputnik V y Astra Zeneca), empleando diferentes plataformas, todas nos vacunan usando como antígeno únicamente la proteína de la espícula o “Spike” del virus, ya que ésta es la proteína que el virus utilizada para infectarnos. Por tanto, una vacuna efectiva debería inducir anticuerpos específicos para todos los “parches” antigénicos de la proteína Spike.
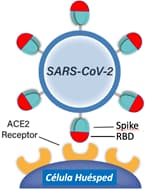
Cuando nos vacunamos, las células del sistema inmune reconocen a la proteína Spike como una molécula extraña, lo que desencadena una división y diferenciación celular que culmina en la producción de anticuerpos y de células T que median la inmunidad celular. Ambas ramas del sistema inmune nos confieren inmunidad, pero son los anticuerpos que circulan en la sangre y se encuentran en las vías respiratorias, los que son la primera barrera que el virus tiene que vencer para infectarnos. Es lógico asumir, entonces, que concentraciones altas de anticuerpos contra la proteína Spike deberían estar asociadas con una protección contra la infección y contra la enfermedad, puesto que dicha proteína es la que el virus utiliza para infectar las células de las fosas nasales al unirse al receptor celular (ACE2).
La proteína Spike, constituida por una cadena de 1,273 aminoácidos, es primero captada por células especializadas del sistema inmune, que la procesan y la exponen en la superficie celular en forma de “parches” de 12 a 18 aminoácidos. Estos “parches” son lo que reconocen las células T para estimular a las células B a producir anticuerpos. Por deducción, entonces, la proteína Spike se presenta al sistema inmune en la forma de “parches” espaciales de un tamaño promedio de 15 aminoácidos y es contra estos “parches” que reaccionan los anticuerpos inducidos por las vacunas. En resumen, las vacunas inducen anticuerpos que reaccionan individualmente contra cada uno de los “parches” de la proteína Spike. Entonces la pregunta del millón es, ¿Todos estos anticuerpos son capaces de neutralizar al virus y protegernos de una infección?
Da la casualidad que de los 1,273 aminoácidos que constituyen la proteína Spike, son únicamente 222 aminoácidos los que hacen contacto con el receptor ACE2 y son los que le dan al virus la capacidad de acoplarse a la célula e infectarla (ver imagen superior). Esta región de la proteína Spike se denomina el Sitio de Unión al Receptor o sea el RBD (del inglés, Receptor Binding Domain).
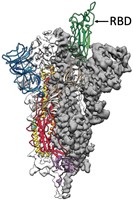
En la imagen de la izquierda se puede apreciar la estructura molecular de la proteína Spike, donde el RBD está coloreado en verde. Los anticuerpos que reaccionan con los “parches” del RBD son los únicos que neutralizan al virus y evitan que infecte la célula. Por ende, esta subpoblación de anticuerpos se denomina anticuerpos neutralizantes.
Es decir, del total de anticuerpos anti-Spike inducidos por la vacuna, sólo una subpoblación es capaz de neutralizar al virus y evitar la infección. ¿Cuál es la evidencia científica que respalda esta conclusión? Resulta que el resto de los anticuerpos que reaccionan con los demás “parches” de la proteína Spike no evitan que el virus infecte a monocapas de células en experimentos de laboratorio in vitro y, por tanto, no están asociados con protección. Los anticuerpos específicos para los parches del RBD, si evitan que el virus infecte a células in vitro y, por tanto, son definidos como neutralizantes.
Ahora bien, la pregunta lógica que nos debemos hacer es, en primer lugar, ¿Todas las personas vacunadas, producen anticuerpos contra todos los “parches” de la proteína Spike, o sea anticuerpos anti-Spike? y, en segundo lugar, si ¿La cantidad de anticuerpos neutralizantes inducida es siempre la misma? La evidencia científica indica que no existe correlación directa entre la cantidad de anticuerpos anti-Spike y de anticuerpos neutralizantes inducidos por la vacuna, dependiendo de varias condiciones, en algunas personas la vacuna induce anticuerpos anti-Spike en concentraciones altas, pero con un porcentaje bajo de anticuerpos neutralizantes. Igualmente, se desconoce cuánto tiempo después de ser vacunada una persona tarda en producir anticuerpos neutralizantes y cuánto tiempo duran en concentraciones adecuadas para conferir protección; o si siempre se producen después de la vacunación. En resumen, si bien la mayor parte de las personas vacunadas desarrollan anticuerpos anti-Spike, no todas desarrollan anticuerpos neutralizantes anti-RBD y su concentración varía en personas vacunadas. También es importante mencionar que la evidencia científica actual no descarta del todo que anticuerpos anti-Spike que no reaccionan contra el RBD confieran también algún grado de protección.
El esquema que sugiero para personas con interés en evaluar la efectividad de la vacuna es, solicitar primero la prueba que detecta anticuerpos totales anti-Spike, por lo menos de 3 a 4 semanas después de la ultima vacuna. Si el resultado es negativo, esto indica que la vacuna no ha sido efectiva pues no indujo anticuerpos totales anti-Spike. Si el resultado es positivo, se procede a solicitar otra prueba que detecta únicamente la subpoblación de anticuerpos neutralizantes anti-RBD, que se miden usando como patrón de comparación el suero 20/260 de la Organización Mundial de la Salud (OMS) proporcionado a través del National Institute for Biological Standards and Control (NIBSC) de Inglaterra.
Finalmente es necesario recalcar que además de anticuerpos, el sistema inmune tiene diversas maneras de protegernos contra infecciones virales, como ser: la inmunidad mediada por células NK que destruyen células infectadas y permiten que los anticuerpos ataquen al virus, la producción de interferón gamma, la citotoxicidad mediada por anticuerpos y muchos otros mecanismos más. Es decir, que, aunque una persona vacunada no desarrolle concentraciones adecuadas de anticuerpos neutralizantes, esto no necesariamente significa que está totalmente desprotegida, pues la inmunidad celular inducida es muy eficiente en conferir protección duradera y robusta. Sin embargo, siendo los anticuerpos anti-Spike nuestra primera línea de defensa y son los que podemos fácilmente detectar y cuantificar en el laboratorio, es importante determinar si dichos anticuerpos contienen una proporción adecuada de anticuerpos neutralizantes asociados con protección, tanto para evaluar la efectividad de la vacuna, como también para decidir cuándo optar por una tercera dosis.






